réservé à la recherche
Nirogacestat (PF-03084014) γ-Secretase inhibitor
N° Cat.S8018
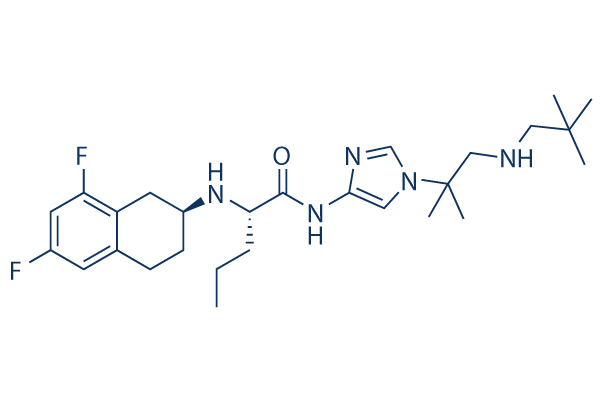
Structure chimique
Poids moléculaire: 489.64
Contrôle qualité
| Cibles apparentées | HDAC Caspase Proteasome MMP HCV Protease Cysteine Protease DPP Tyrosinase HIV Protease Serine Protease |
|---|---|
| Autre Secretase Inhibiteurs | DAPT RO4929097 (RG-4733) LY411575 Dibenzazepine (YO-01027) Avagacestat (BMS-708163) Semagacestat (LY450139) MK-0752 MDL-28170 L-685,458 NGP 555 |
Informations chimiques, stockage et stabilité
| Poids moléculaire | 489.64 | Formule | C27H41F2N5O |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1290543-63-3 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | PF-3084014 | Smiles | CCCC(C(=O)NC1=CN(C=N1)C(C)(C)CNCC(C)(C)C)NC2CCC3=C(C2)C(=CC(=C3)F)F | ||
Solubilité
|
In vitro |
DMSO
: 98 mg/mL
(200.14 mM)
Ethanol : 49 mg/mL Water : Insoluble |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
gamma-secretase
(cell-free assay) 6.2 nM
|
|---|---|
| In vitro |
Nirogacestat (PF-03084014) inhibe le clivage du récepteur Notch dans des essais cellulaires utilisant des cellules HPB-ALL qui hébergent des mutations dans les domaines d'hétérodimérisation et de PEST dans Notch1 avec une IC50 de 13,3 nM. Il régule à la baisse les gènes cibles de Notch Hes-1 et l'expression de cMyc dans les cellules HPB-ALL avec des IC50 de <1 nM et 10 nM, respectivement, et inhibe la croissance cellulaire d'un sous-ensemble de lignées cellulaires T-ALL humaines (HPB-ALL, DND-41, TALL-1 et Sup-T1) par induction de l'arrêt du cycle cellulaire et de l'apoptosis avec des IC50 de 30 à 100 nM. Ce composé réduit la prolifération des HUVEC avec une IC50 de 0,5 μM et diminue la formation de lumière avec une valeur IC50 de 50 nM. Il (1 μM) n'a pas d'effet antiprolifératif dans les cellules MX1 ; cependant, il inhibe la migration de 95%.
|
| Kinase Assay |
dosage de γ-secretase
|
|
Un fragment d'ADN codant pour les acides aminés 596 à 695 de l'isoforme 695-aa de l'APP (APP695) et la séquence Flag (DYKDDDDK) à l'extrémité C-terminale est généré par amplification PCR avec des oligonucléotides conçus de manière appropriée et l'ADNc APP695. Le Met qui sert de site de démarrage de la traduction est le résidu 596 de l'APP695 (le résidu P1 par rapport au site de clivage de la β-secretase). Ce fragment d'ADN est inséré dans le vecteur d'expression procaryote pET2-21b. La protéine recombinante, C100Flag, est surproduite chez Escherichia coli [souche BL21(DE3)] et purifiée par chromatographie sur colonne Mono-Q. Le C100Flag (1,7 μM) est incubé avec des membranes cellulaires (0,5 mg/mL) en présence de CHAPSO, CHAPS (3-[(3-cholamidopropyl)dim-ethylammonio]-1-propanesulfonate) ou Triton X-100 (0, 0,125, 0,25, 0,5 ou 1%) dans le tampon B (50 mM Pipes, pH 7,0y 5mM MgCl2/5 mM CaCl2/150 mM KCl) à 37°C. Les réactions sont arrêtées par addition de RIPA (150 mM NaCl/1,0% NP-40/0,5% désoxycholate de sodiumy 0,1% SDS/50 mM Tris HCl, pH 8,0) et ébullition pendant 5 min. Les échantillons sont centrifugés et les solutions de surnageant sont analysées pour les peptides Aβ par ECL. Les produits liés à Aβ40 et Aβ42 issus du traitement médié par la γ-secretase du C100Flag possèdent un Met à l'extrémité N-terminale et sont ainsi définis comme M-Aβ40 et M-Aβ42, respectivement. De même, la solution de surnageant (0,125 mg/mL) de membranes cellulaires HeLa extraites au CHAPSO (γ-secretase solubilisée) est incubée avec C100Flag (1,7 μM) dans le tampon B contenant 0,25% de CHAPSO et ensuite analysée pour M-Aβ40 et M-Aβ42 en utilisant l'ECL. Ce composé, Nirogacestat (PF-03084014), est utilisé dans le contexte expérimental.
|
|
| In vivo |
Le Nirogacestat (PF-03084014) administré par voie orale en une dose unique de 200 mg/kg provoque une inhibition maximale de NICD d'environ 80% dans les tumeurs xénogreffes HPB-ALL. Il montre une activité antitumorale robuste dans ce mode avec une inhibition maximale de la croissance tumorale d'environ 92% à une dose de 150 mg/kg, accompagnée d'une réduction significative de NICD/Notch1, de l'indice mitotique tumoral (Ki67) et de la coloration de l'apoptosis (caspase-3 activée). À 120 mg/kg, ce composé induit l'apoptosis, l'antiprolifération, réduit la capacité d'auto-renouvellement des cellules tumorales, altère la vascularisation tumorale et diminue l'activité métastatique chez les souris porteuses de tumeurs HCC1599 de cancer du sein. Son traitement présente une activité antitumorale significative dans différents types de modèles de xénogreffes mammaires avec une valeur TGI d'au moins 50%.
|
Références |
|
Applications
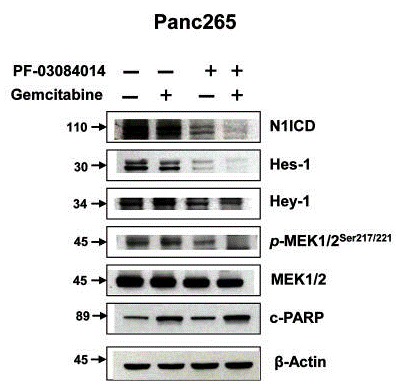
| Méthodes | Biomarqueurs | Images | PMID |
|---|---|---|---|
| Western blot | N1ICD / Hes-1 / Hey-1 / p-MEK / MEK / c-PARP |
|
23402814 |
Informations sur lessai clinique
(données de https://clinicaltrials.gov, mis à jour le 2024-05-22)
| Numéro NCT | Recrutement | Conditions | Sponsor/Collaborateurs | Date de début | Phases |
|---|---|---|---|---|---|
| NCT02338531 | Withdrawn | Breast Cancer |
Jules Bordet Institute |
June 2015 | Phase 2 |
| NCT02299635 | Terminated | Triple Negative Breast Neoplasms |
Pfizer |
February 3 2015 | Phase 2 |
| NCT02109445 | Terminated | Metastatic Cancer Pancreas |
Pfizer|Academic GI Cancer Consortium (AGICC) |
September 3 2014 | Phase 2 |
| NCT01876251 | Terminated | Breast Cancer Metastatic |
Pfizer |
November 4 2013 | Phase 1 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
