uitsluitend voor onderzoeksdoeleinden
Dovitinib (TKI258) Lactate monohydrate FLT3 inhibitor
Cat.Nr.S7765
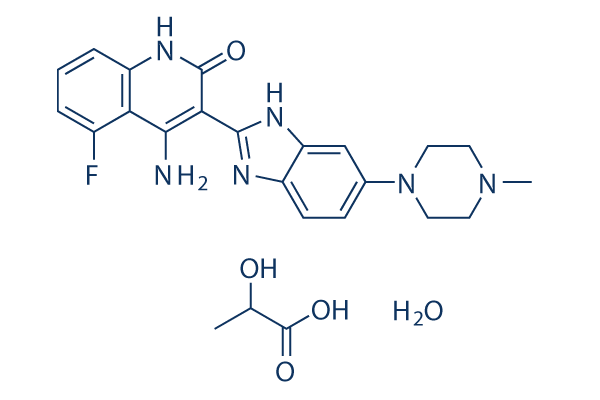
Chemische structuur
Moleculair gewicht: 500.52
Kwaliteitscontrole
| Gerelateerde doelwitten | EGFR VEGFR JAK PDGFR FGFR Src HIF FLT HER2 Bcr-Abl |
|---|---|
| Overige FLT3 Inhibitoren | UNC2025 Crenolanib (CP-868596) Dovitinib (TKI-258) Tandutinib (MLN518) KW-2449 ENMD-2076 AST-487 (NVP-AST487) TCS 359 G-749 AMG 925 |
Chemische informatie, Opslag en Stabiliteit
| Moleculair gewicht | 500.52 | Formule | C24H29FN6O5 |
Opslag (Vanaf de ontvangstdatum) | |
|---|---|---|---|---|---|
| CAS-nr. | 915769-50-5 | SDF downloaden | Opslag van stamoplossingen |
|
|
| Synoniemen | CHIR258 | Smiles | CC(C(=O)O)O.CN1CCN(CC1)C2=CC3=C(C=C2)N=C(N3)C4=C(C5=C(C=CC=C5F)NC4=O)N.O | ||
Oplosbaarheid
|
In vitro |
DMSO
: 100 mg/mL
(199.79 mM)
Water : 66 mg/mL Ethanol : 1 mg/mL |
Molariteitscalculator
|
In vivo |
|||||
In vivo Formuleringscalculator (Heldere oplossing)
Stap 1: Voer de onderstaande informatie in (Aanbevolen: Een extra dier voor het geval van verlies tijdens het experiment)
Stap 2: Voer de in vivo formulering in (Dit is alleen de calculator, geen formulering. Neem eerst contact met ons op als er geen in vivo formulering is in het gedeelte Oplosbaarheid.)
Berekeningsresultaten:
Werkconcentratie: mg/ml;
Methode voor het bereiden van DMSO-mastervloeistof: mg geneesmiddel vooraf opgelost in μL DMSO ( Concentratie mastervloeistof mg/mL, Neem eerst contact met ons op als de concentratie de DMSO-oplosbaarheid van de partij geneesmiddel overschrijdt. )
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toeμL PEG300, mengen en helder maken, voeg vervolgens toeμL Tween 80, mengen en helder maken, voeg vervolgens toe μL ddH2O, mengen en helder maken.
Methode voor het bereiden van in vivo formulering: Neem μL DMSO mastervloeistof, voeg vervolgens toe μL Maïsolie, mengen en helder maken.
Opmerking: 1. Zorg ervoor dat de vloeistof helder is voordat u het volgende oplosmiddel toevoegt.
2. Zorg ervoor dat u het/de oplosmiddel(en) in de juiste volgorde toevoegt. U moet ervoor zorgen dat de verkregen oplossing, bij de vorige toevoeging, een heldere oplossing is voordat u verdergaat met het toevoegen van het volgende oplosmiddel. Fysische methoden zoals vortexen, echografie of een warmwaterbad kunnen worden gebruikt om het oplossen te bevorderen.
Werkingsmechanisme
| Targets/IC50/Ki |
FLT3
1 nM
c-Kit
2 nM
FGFR1
8 nM
VEGFR3/FLT4
8 nM
FGFR3
9 nM
VEGFR1/FLT1
10 nM
VEGFR2/Flk1
13 nM
PDGFRβ
27 nM
CSF-1R/c-Fms
36 nM
|
|---|---|
| In vitro |
Dovitinib remt krachtig de FGF-gestimuleerde groei van WT- en F384L-FGFR3-expresserende B9-cellen met een IC50 van 25 nM. Bovendien remt Dovitinib de proliferatie van B9-cellen die elk van de verschillende geactiveerde mutanten van FGFR3 tot expressie brengen. Interessant is dat er minimale waargenomen verschillen zijn in de gevoeligheid van de verschillende FGFR3-mutaties voor Dovitinib, waarbij de IC50 varieert van 70 tot 90 nM voor elk van de verschillende mutaties. IL-6-afhankelijke B9-cellen die alleen een vector bevatten (B9-MINV-cellen) zijn resistent tegen de remmende activiteit van Dovitinib bij concentraties tot 1 μM. Dovitinib remt de celproliferatie van KMS11 (FGFR3-Y373C), OPM2 (FGFR3-K650E) en KMS18 (FGFR3-G384D) cellen met een IC50 van respectievelijk 90 nM (KMS11 en OPM2) en 550 nM. Dovitinib remt FGF-gemedieerde ERK1/2-fosforylering en induceert cytotoxiciteit in FGFR3-expresserende primaire MM-cellen. BMSCs verlenen een bescheiden mate van resistentie met 44,6% groeiremming voor cellen behandeld met 500 nM Dovitinib en gekweekt op stroma, vergeleken met 71,6% groeiremming voor cellen gekweekt zonder BMSCs. Dovitinib remt de proliferatie van M-NFS-60, een M-CSF-groeigedreven muis myeloblastische cellijn met een mediane effectieve concentratie (EC50) van 220 nM. Behandeling van SK-HEP1-cellen met Dovitinib resulteert in een dosisafhankelijke vermindering van het celnummer en G2/M-fase-arrestatie met vermindering in de G0/G1- en S-fasen, remming van anchorage-onafhankelijke groei en blokkering van bFGF-geïnduceerde celmotiliteit. De IC50 voor Dovitinib in SK-HEP1-cellen is ongeveer 1,7 μM. Dovitinib vermindert ook significant de basale fosforyleringsniveaus van FGFR-1, FGFR substrate 2α (FRS2-α) en ERK1/2, maar niet Akt in zowel SK-HEP1- als 21-0208-cellen. In 21-0208 HCC-cellen remt Dovitinib significant bFGF-geïnduceerde fosforylering van FGFR-1, FRS2-α, ERK1/2, maar niet Akt. |
| Kinase Assay |
In vitro kinase testen
|
|
De remmende concentratie van 50% (IC50) waarden voor de remming van RTK's door Dovitinib worden bepaald in een tijdopgeloste fluorescentie (TRF) of radioactieve vorm, waarbij de remming door Dovitinib van fosfaatoverdracht naar een substraat door het respectievelijke enzym wordt gemeten. De kinase domeinen van FGFR3, FGFR1, PDGFR
P
en VEGFR1-3 worden getest in 50 mM HEPES (N-2-hydroxyethylpiperazine-N'-2-ethaansulfonzuur), pH 7.0, 2 mM MgCl2, 10 mM MnCl2 1 mM NaF, 1 mM dithiothreitol (DTT), 1 mg/mL bovine serum albumine (BSA), 0.25 μM gebiotinyleerd peptide substraat (GGGGQDGKDYIVLPI), en 1 tot 30 μM adenosine trifosfaat (ATP) afhankelijk van de Km voor het respectievelijke enzym. ATP-concentraties zijn op of net onder Km. Voor c-KIT en FLT3 reacties wordt de pH verhoogd tot 7.5 met 0.2 tot 8 μM ATP in aanwezigheid van 0.25 tot 1 μM gebiotinyleerd peptide substraat (GGLFDDPSYVNVQNL). Reacties worden 1 tot 4 uur geïncubeerd bij kamertemperatuur en het gefosforyleerde peptide wordt opgevangen op streptavidin-gecoate microtiterplaten die een stopreactiebuffer bevatten (25 mM EDTA [ethyleendiaminetetraazijnzuur], 50 mM HEPES, pH 7.5). Gefosforyleerd peptide wordt gemeten met het DELFIA TRF-systeem met behulp van een Europium-gelabeld anti-fosfotyrosine antilichaam PT66. De concentratie van Dovitinib voor IC50 wordt berekend met behulp van niet-lineaire regressie met XL-Fit data-analysesoftware versie 4.1 (IDBS). Remming van colony-stimulating factor-1 receptor (CSF-1R), PDGFR
P
, insulinereceptor (InsR) en insulin-like growth factor receptor 1 (IGFR1) kinase activiteit wordt bepaald bij ATP-concentraties dicht bij de Km voor ATP.
|
|
| In vivo |
Dovitinib induceert zowel cytostatische als cytotoxische responsen in vivo, wat resulteert in regressie van FGFR3-expresserende tumoren. Dovitinib toont een dosis- en blootstellingsafhankelijke remming van doelreceptor tyrosinekinasen (RTK's) tot expressie gebracht in tumortransplantaten. Dovitinib remt krachtig de tumorgroei van zes HCC-lijnen. Remming van Angiogenesis correleerde met inactivatie van FGFR/PDGFR P /VEGFR2 signaalwegen. In een orthotoop model remt Dovitinib krachtig de primaire tumorgroei en longmetastase en verlengde significant de overleving van muizen. Toediening van Dovitinib resulteert in significante tumorgroeiremming en tumorregressies, inclusief grote, gevestigde tumoren (500-1.000 mm3). |
Referenties |
|
Informatie klinische proef
(gegevens van https://clinicaltrials.gov, bijgewerkt op 2024-05-22)
| NCT-nummer | Rekrutering | Aandoeningen | Sponsor/Medewerkers | Startdatum | Fasen |
|---|---|---|---|---|---|
| NCT05571969 | Recruiting | Advanced Solid Tumors |
Allarity Therapeutics|Amarex Clinical Research |
February 20 2023 | Phase 1 |
| NCT02268435 | Withdrawn | Gastrointestinal Stromal Tumors |
Asan Medical Center |
March 2015 | Phase 1 |
| NCT01700270 | Completed | Advanced Solid Tumors Excluding Breast Cancer |
Novartis Pharmaceuticals|Novartis |
May 2013 | Phase 1 |
| NCT01680796 | Withdrawn | Multiple Myeloma |
University of Florida|Novartis Pharmaceuticals |
February 2013 | Phase 1 |
| NCT01266070 | Terminated | Von Hippel-Lindau Syndrome |
M.D. Anderson Cancer Center|Novartis |
November 2012 | Phase 2 |
Technische ondersteuning
Tel: +1-832-582-8158 Ext:3
Als u nog andere vragen heeft, kunt u een bericht achterlaten.
