réservé à la recherche
NSC 23766 Trihydrochloride Inhibiteur de la GTPase Rac
N° Cat.S8031
Structure chimique
Poids moléculaire: 530.97
Contrôle qualité
| Cibles apparentées | CDK HSP PD-1/PD-L1 ROCK Wee1 DNA/RNA Synthesis Microtubule Associated Ras KRas Aurora Kinase |
|---|---|
| Autre Rho Inhibiteurs | EHop-016 CCG-1423 ML141 (CID-2950007) EHT 1864 2HCl ZCL278 MBQ-167 CCG-203971 Rhosin hydrochloride CID44216842 1A-116 |
Culture cellulaire, traitement et concentration de travail
| Lignées cellulaires | Type dessai | Concentration | Temps dincubation | Formulation | Description de lactivité | PMID |
|---|---|---|---|---|---|---|
| RA4 | Function Assay | 50 μM | 24 h | inhibits Matrigel invasion | 17622308 | |
| RA3 | Function Assay | 50 μM | 24 h | inhibits Matrigel invasion | 17622308 | |
| RA2 | Function Assay | 50 μM | 24 h | inhibits Matrigel invasion | 17622308 | |
| RA1 | Function Assay | 50 μM | 24 h | inhibits Matrigel invasion | 17622308 | |
| RA-FLS (RA2) | Growth Inhibition Assay | 25/50 μM | 1-9 d | inhibits cell growth in both dose and time dependent manner | 17622308 | |
| IEC-6 | Function Assay | 120 µM | 4/6/8 h | prevents the increased activation of FAK at 6 and 8 h | 20448461 | |
| MDA-MB-231 | Function Assay | 50/100 μM | 48 h | induces a dose-dependent decrease in phosphorylation of p65 subunit | 20515940 | |
| MDA-MB-468 | Function Assay | 50/100 μM | 48 h | induces a dose-dependent decrease in phosphorylation of p65 subunit | 20515940 | |
| MDA-MB-231 | Function Assay | 50/100 μM | 24 h | increases phosphorylation of JNK in a dose dependent manner | 20515940 | |
| MDA-MB-468 | Function Assay | 50/100 μM | 24 h | increases phosphorylation of JNK in a dose dependent manner | 20515940 | |
| MDA-MB-468 | Function Assay | 100 μM | 24 h | inhibits caspase-3 activation | 20515940 | |
| MDA-MB-468 | Apoptosis Assay | 50/100 μM | 24 h | induces apoptosis | 20515940 | |
| T47D | Function Assay | 100 μM | 48 h | increases the cell number in G1 phase and decreases the cell number in S and G2-M phases | 20515940 | |
| MCF7 | Function Assay | 100 μM | 48 h | increases the cell number in G1 phase and decreases the cell number in S and G2-M phases | 20515940 | |
| MDA-MB-231 | Function Assay | 100 μM | 48 h | increases the cell number in G1 phase and decreases the cell number in S and G2-M phases | 20515940 | |
| MDA-MB-231 | Function Assay | 0-100 μM | 24 h | selectively inhibits Rac1 activation without interfering with the activity of the closely related small GTPase Cdc42 | 20515940 | |
| MDA-MB-231 | Cytotoxicity Assay | 0-100 μM | 48 h | decreases cell viability in a dose dependent manner | 20515940 | |
| MDA-MB-468 | Cytotoxicity Assay | 0-100 μM | 48 h | decreases cell viability in a dose dependent manner | 20515940 | |
| T47D | Cytotoxicity Assay | 0-100 μM | 48 h | decreases cell viability in a dose dependent manner | 20515940 | |
| MCF7 | Cytotoxicity Assay | 0-100 μM | 48 h | decreases cell viability in a dose dependent manner | 20515940 | |
| SKBR3-pMKO.1 | Function Assay | 50 μM | 24 h | inhibits Rac1 activation | 21943825 | |
| SKBR3 | Function Assay | 50 μM | 24 h | inhibits Rac1 activation | 21943825 | |
| NCI-H1703 | Function Assay | 0-500 μM | 24 h | diminishes basal NF-κB activity dose dependently | 22549160 | |
| NCI-H1703 | Function Assay | 100 μg/ml | 24 h | slows progression through the G1 phase of the cell cycle | 22549160 | |
| NCI-H1703 | Growth Inhibition Assay | 0-500 μM | 24 h | inhibits cell growth in a dose dependent manner | 22549160 | |
| T98MG | Function Assay | 50 mM | 24 h | DMSO | enhances the antimigratory effect of erlotinib | 23832120 |
| A172MG | Function Assay | 50 mM | 24 h | DMSO | enhances the antimigratory effect of erlotinib | 23832120 |
| U87MG | Function Assay | 50 mM | 24 h | DMSO | enhances the antimigratory effect of erlotinib | 23832120 |
| PC40 | Cell Viability Assay | 50 mM | 144 h | DMSO | exhibits synergistic antiproliferative effects combined treatment with erlotinib | 23832120 |
| PC38 | Cell Viability Assay | 50 mM | 144 h | DMSO | exhibits synergistic antiproliferative effects combined treatment with erlotinib | 23832120 |
| T98MG | Cell Viability Assay | 50 mM | 144 h | DMSO | exhibits synergistic antiproliferative effects combined treatment with erlotinib | 23832120 |
| A172MG | Cell Viability Assay | 50 mM | 144 h | DMSO | exhibits synergistic antiproliferative effects combined treatment with erlotinib | 23832120 |
| U87MG | Cell Viability Assay | 50 mM | 144 h | DMSO | exhibits synergistic antiproliferative effects combined treatment with erlotinib | 23832120 |
| Ki-67+ CLL | Growth Inhibition Assay | 50 µM | 5 d | decreases the number of Ki-67+ CLL cells | 24501217 | |
| NIH3T3 | Growth Inhibition Assay | 100 μM | 24 h | has no significant impact on cell viability | 25037060 | |
| U2-OS | Function Assay | 100 μM | 24 h | DMSO | induces cell cycle arrest in the G1 phase | 25109327 |
| SW480 | Function Assay | 100 μM | 24 h | DMSO | induces cell cycle arrest in the G1 phase | 25109327 |
| A431 | Function Assay | 100 μM | 24 h | DMSO | induces cell cycle arrest in the G1 phase | 25109327 |
| U2-OS | Growth Inhibition Assay | 100 μM | 24/48/72 h | inhibits cell growth in a time dependent manner | 25109327 | |
| SW480 | Growth Inhibition Assay | 100 μM | 24/48/72 h | inhibits cell growth in a time dependent manner | 25109327 | |
| A431 | Growth Inhibition Assay | 100 μM | 24/48/72 h | inhibits cell growth in a time dependent manner | 25109327 | |
| RBMECs | Function Assay | 100 μM | 30 min | blockes 6Bnz-cAMP-mediated activation of Rac1 in EMAP-II-treated RBMECs | 26358039 | |
| human aortic smooth muscle cells | Function Assay | 50 uM | Inhibition of Rac1 binding to Pak1 in human aortic smooth muscle cells at 50 uM by SDS-PAGE based chemiluminescence | 19527032 | ||
| human aortic smooth muscle cells | Function Assay | 100 μM | Inhibition of Rac1 binding to Pak1 in human aortic smooth muscle cells at 100 uM by SDS-PAGE based chemiluminescence | 19527032 | ||
| Cliquez pour voir plus de données expérimentales sur les lignées cellulaires | ||||||
Informations chimiques, stockage et stabilité
| Poids moléculaire | 530.97 | Formule | C24H35N7.3ClH |
Stockage (À partir de la date de réception) | |
|---|---|---|---|---|---|
| N° CAS | 1177865-17-6 | Télécharger le SDF | Stockage des solutions mères |
|
|
| Synonymes | N/A | Smiles | CCN(CC)CCCC(C)NC1=NC(=CC(=N1)NC2=CC3=C(C=C(N=C3C=C2)C)N)C.Cl.Cl.Cl | ||
Solubilité
|
In vitro |
DMSO
: 106 mg/mL
(199.63 mM)
Water : 106 mg/mL Ethanol : 5 mg/mL |
Calculateur de molarité
|
In vivo |
|||||
Calculateur de formulation in vivo (Solution claire)
Étape 1 : Entrez les informations ci-dessous (Recommandé : Un animal supplémentaire pour tenir compte des pertes pendant lexpérience)
Étape 2 : Entrez la formulation in vivo (Ceci nest que le calculateur, pas la formulation. Veuillez nous contacter dabord sil ny a pas de formulation in vivo dans la section Solubilité.)
Résultats du calcul :
Concentration de travail : mg/ml;
Méthode de préparation du liquide maître DMSO : mg médicament prédissous dans μL DMSO ( Concentration du liquide maître mg/mL, Veuillez nous contacter dabord si la concentration dépasse la solubilité du DMSO du lot de médicament. )
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuiteμL PEG300, mélanger et clarifier, ajouter ensuiteμL Tween 80, mélanger et clarifier, ajouter ensuite μL ddH2O, mélanger et clarifier.
Méthode de préparation de la formulation in vivo : Prendre μL DMSO liquide maître, ajouter ensuite μL Huile de maïs, mélanger et clarifier.
Remarque : 1. Assurez-vous que le liquide est clair avant dajouter le solvant suivant.
2. Assurez-vous dajouter le(s) solvant(s) dans lordre. Vous devez vous assurer que la solution obtenue lors de lajout précédent est une solution claire avant de procéder à lajout du solvant suivant. Des méthodes physiques telles que le vortex, les ultrasons ou le bain-marie peuvent être utilisées pour faciliter la dissolution.
Mécanisme daction
| Targets/IC50/Ki |
Rac GTPase
(Cell-free assay) 50 μM
|
|---|---|
| In vitro |
NSC23766 est identifié pour s'insérer dans une rainure de surface de Rac1 connue pour être critique pour la spécification du GEF. NSC23766 inhibe efficacement la liaison et l'activation de Rac1 par le GEF Trio ou Tiam1 spécifique de Rac de manière dose-dépendante sans interférer avec la liaison ou l'activation de Cdc42 ou RhoA étroitement liés par leurs GEF respectifs ou avec l'interaction de Rac1 avec BcrGAP ou l'effecteur PAK1. NSC 23766 est actif dans la régulation des fonctions de la GTPase Rac sur le cytosquelette et de nombreuses fonctions cellulaires, y compris le Cell Cycle, la croissance cellulaire, l'adhésion, la migration et la transcription génique. NSC 23766 (50 μM) bloque puissamment l'activation de Rac1 et la formation de lamellipodes induites par le sérum ou le facteur de croissance dérivé des plaquettes sans affecter l'activité de Cdc42 endogène ou RhoA dans les cellules NIH 3T3. NSC 23766 réduit la croissance des cellules NIH 3T3 stimulées par Trio ou Tiam1 mais pas par Vav, Lbc, Intersectin, ou un mutant Rac1 constitutivement actif et supprime la transformation cellulaire induite par Trio, Tiam1 ou Ras. NSC23766 inhibe de manière dose-dépendante la prolifération des cellules PC-3 et la croissance indépendante de l'ancrage. 25 μM NSC23766 inhibe l'invasion des cellules PC-3 à travers le Matrigel de 85 %. [1] 50 μM NSC 23766 inhibe l'activation induite par la thrombine de Rac1 et Rac2 dans les plaquettes humaines, ainsi que l'agrégation plaquettaire. NSC23766 prévient la production d'Aβ40 et Aβ42 dans les cellules swAPP-HEK293 sans affecter Notch et sAPPα. NSC23766 prévient l'activité γ-sécrétase dans la cellule, mais n'agit pas comme un inhibiteur direct de la γ-sécrétase. NSC23766 réduit de manière dose-dépendante les niveaux d'Aβ40 sécrété et intracellulaire avec une IC50 de 48,94 μM. 50 μM NSC 23766 inhibe la libération d'Aβ42 de 57,97 %. NSC23766 régule l'expression de l'oxyde nitrique synthase endothéliale et la fonction endothéliale. 100 μM NSC23766 réprime l'activité du promoteur de l'eNOS de 60 % dans les CE aortiques bovines et de 30 % à 35 % dans les cellules bEND.3. L'inhibition de Rac1 avec NSC23766 déstabilise l'ARNm de l'eNOS et raccourcit sa demi-vie à 17 heures. NSC23766 atténue de manière dose-dépendante la relaxation des anneaux aortiques de souris de type sauvage induite par l'ACh. NSC23766 inhibe la croissance cellulaire et induit l'apoptose. NSC23766 diminue la viabilité des cellules MDA-MB-468 et MDA-MB-231 de manière dose-dépendante avec une IC50 d'environ 10 μM, ce qui n'est pas corrélé avec le statut du récepteur d'œstrogène (ER), du récepteur de progestérone (PR), de Her2 et de la mutation p53. NSC23766 a peu d'effet sur la survie des cellules épithéliales mammaires normales MCF12A. Après 24 heures d'exposition à NSC 23766, les cellules MDA-MB-231 montrent une augmentation de 41 % à 65 % en phase G1 et une diminution concomitante des phases S et G2-M. 100 μM NSC23766 induit une augmentation de six fois de l'apoptose des cellules MDA-MB-468. L'inhibition par NSC23766 de l'arrêt du Cell Cycle ou de l'apoptose dans les cellules cancéreuses du sein est médiatisée par la régulation négative de la cycline D1, de la survivine et de l'inhibiteur de l'apoptose lié à l'X. |
| Kinase Assay |
Dosage de l'activité de la Rho GTPase
|
|
Les cellules sont cultivées en phase logarithmique dans une boîte de 10 cm, et sont privées de sérum dans un milieu à 0,5 % ou indiqué autrement pendant 24 h avant la lyse dans un tampon contenant 20 mM Tris HCl (pH 7,6), 100 mM NaCl, 10 mM MgCl2, 1 % Nonidet P-40, 10 % glycérol et 1× mélange d'inhibiteurs de protéase. Les lysats sont clarifiés, les concentrations de protéines sont normalisées et le Rac1 lié au GTP dans les lysats est mesuré par un test de pull-down du domaine effecteur. Pour le test de pull-down His6-PAK1 PBD, les lysats cellulaires sont incubés avec le domaine His6-PAK1 PBD immobilisé sur Ni2+-agarose (~1 μg chacun) purifié d'E. coli pendant 30 min. Les co-précipités de Ni2+-agarose sont lavés deux fois dans le tampon de lavage et analysés par immunobuvardage avec un anticorps monoclonal anti-Rac1.
|
|
| In vivo |
NSC 23766 Trihydrochloride induit la mobilisation des cellules souches/progénitrices hématopoïétiques. L'administration intrapéritonéale de NSC 23766 Trihydrochloride (2,5 mg/kg) à la souche de souris C57Bl/6 « faiblement mobilisatrice » entraîne une augmentation de deux fois du nombre de cellules souches/progénitrices hématopoïétiques circulantes 6 heures après l'injection. NSC 23766 Trihydrochloride atténue les lésions pulmonaires aiguës induites par le lipopolysaccharide chez la souris. Le traitement avec NSC 23766 Trihydrochloride à 1 ou 3 mg/kg réduit non seulement l'infiltration des cellules inflammatoires et les activités de la MPO, mais inhibe également l'expression des ARNm des médiateurs pro-inflammatoires, le facteur de nécrose tumorale-α et l'interleukine-1β. NSC 23766 Trihydrochloride réduit également l'accumulation d'Evans Blue et d'albumine dans les poumons soumis au LPS. |
Références |
|
Applications
| Méthodes | Biomarqueurs | Images | PMID |
|---|---|---|---|
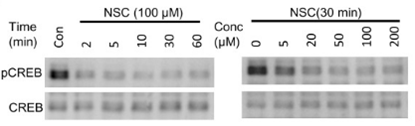
| Western blot | pCREB / CREB OCT4 / SOX2 / Nanog active Rac1 / Rac1 |
|
25319697 |
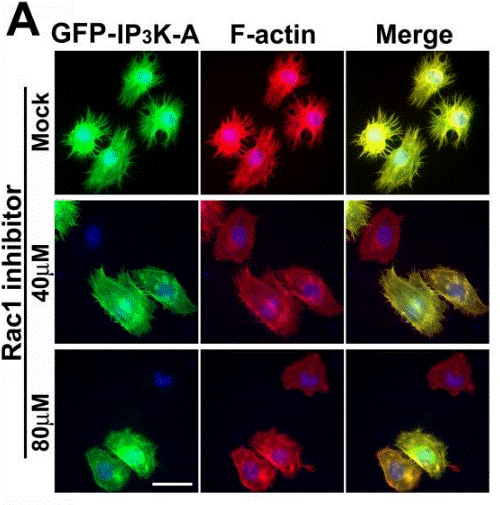
| Immunofluorescence | IP3K-A / F-actin BART / Rac1 |
|
19890013 |
Support technique
Tel: +1-832-582-8158 Ext:3
Si vous avez dautres questions, veuillez laisser un message.
