연구용
Ticarcillin sodium Selection Antibiotics for Transfected Cell 억제제
제품 번호S3193
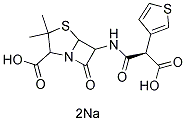
화학 구조
분자량: 430.41
품질 관리
| 관련 타겟 | Integrase Bacterial Antibiotics Anti-infection Fungal Antiviral COVID-19 Parasite Reverse Transcriptase HIV |
|---|---|
| 기타 Selection Antibiotics for Transfected Cell 억제제 | Blasticidin S Hydrochloride Ribostamycin Sulfate D-Cycloserine |
화학 정보, 보관 및 안정성
| 분자량 | 430.41 | 화학식 | C15H16N2O6S2.2Na |
보관 (수령일로부터) | |
|---|---|---|---|---|---|
| CAS 번호 | 29457-07-6 | SDF 다운로드 | 원액 보관 |
|
|
| 동의어 | AB 2288, BRL 2288 | Smiles | CC1(C(N2C(S1)C(C2=O)NC(=O)C(C3=CSC=C3)C(=O)[O-])C(=O)[O-])C.[Na+].[Na+] | ||
용해도
|
In vitro |
DMSO
: 86 mg/mL
(199.8 mM)
Water : 86 mg/mL Ethanol : Insoluble |
몰농도 계산기
|
In vivo |
|||||
생체 내 제형 계산기 (투명한 용액)
1단계: 아래 정보 입력 (권장: 실험 중 손실을 고려하여 추가 동물 포함)
2단계: 생체 내 제형 입력 (이것은 계산기일 뿐 제형이 아닙니다. 용해도 섹션에 생체 내 제형이 없는 경우 먼저 당사에 문의하십시오.)
계산 결과:
작업 농도: mg/ml;
DMSO 원액 준비 방법: mg 약물 사전 용해 μL DMSO ( 원액 농도 mg/mL, 농도가 해당 약물 배치의 DMSO 용해도를 초과하는 경우 먼저 당사에 문의하십시오. )
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가μL PEG300, 혼합하고 투명하게 한 다음 추가μL Tween 80, 혼합하고 투명하게 한 다음 추가 μL ddH2O, 혼합하고 투명하게 합니다.
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가 μL 옥수수 기름, 혼합하고 투명하게 합니다.
참고: 1. 다음 용매를 추가하기 전에 액체가 투명한지 확인하십시오.
2. 용매를 순서대로 추가해야 합니다. 다음 용매를 추가하기 전에 이전 추가에서 얻은 용액이 투명한 용액인지 확인해야 합니다. 와동, 초음파 또는 뜨거운 물 중탕과 같은 물리적 방법을 사용하여 용해를 도울 수 있습니다.
작용 메커니즘
| 시험관 내(In vitro) |
클라불란산 첨가 시, Ticarcillin (64 mg/mL)의 90% 베타-락타마제 양성 균주에 대한 MIC는 2 mg/mL로 감소합니다. Ticarcillin의 90% 베타-락타마제 음성 균주에 대한 MIC는 4 mg/mL입니다. 베타-락타마제 생성 균주의 93.4%는 64 mg/mL 이하에서 Ticarcillin에 감수성을 보입니다. Ticarcillin/potassium clavulanate는 빛에 안정하며 β-락타마제에 의한 불활성화에 저항력이 있습니다. Ticarcillin/potassium clavulanate는 식물 형질전환에서 Agrobacterium tumefaciens를 제거하는 데 카베니실린 및 세포탁심보다 경제적입니다.
|
|---|---|
| 생체 내(In vivo) |
혈청에서 Ticarcillin (120 mg/kg)의 평균 제거 반감기는 대조군에서 70.8분, 낭포성 섬유증 환자에서 53.1분입니다. Ticarcillin의 총 신체 청소율은 낭포성 섬유증 환자에서 유의하게 높습니다 (대조군 46.2 mL/min/m2 대비 65.6 mL/min/m2). Ticarcillin의 비신장 청소율도 낭포성 섬유증 환자에서 유의하게 높습니다 (대조군 13.3 mL/min/m2 대비 24.8 mL/min/m2). Ticarcillin/clavulanate (3.1g, 4-6시간마다 정맥 주사)는 복잡한 피부 및 피부 구조 감염 치료에서 80.3%의 임상 성공률과 19.7%의 임상 실패율을 보입니다. 미생물학적으로 평가 가능한 집단에서 Ticarcillin/clavulanate 치료 그룹의 전체 박멸률은 83.7%입니다. Ticarcillin/clavulanate는 소아 및 성인 환자의 복부 내 감염 치료를 위한 최종 평가 시점에서 79%의 완치율을 보입니다.
|
참조 |
|
임상시험 정보
(데이터 출처 https://clinicaltrials.gov, 업데이트 날짜 2024-05-22)
| NCT 번호 | 모집 | 조건 | 스폰서/협력자 | 시작일 | 단계 |
|---|---|---|---|---|---|
| NCT01229046 | Withdrawn | Sepsis |
Phillip Brian Smith|Duke University |
September 2010 | Phase 1 |
