연구용
Anti-DYKDDDDK Tag magnetic beads
Anti-DYKDDDDK Tag 자기 비드는 고품질 재조합 마우스 단일클론 항체와 공유 결합된 하이드록실 자기 비드를 기반으로 합니다. DYKDDDDK-태그 단백질의 높은 로딩(0.6 mg 단백질/mL 이상)과 높은 특이성을 가지고 있어 공동 면역침강 및 단백질 정제에 사용하는 것이 좋습니다.
Sellecks 인용됨 119 출판물
장점
시간 절약: 아가로스 비드에 비해 15-30분 절약.
간단한 조작: 자기 분리 및 원심분리 불필요.
높은 단백질 로딩 용량.
높은 특이성.
제품 비교
설명
Anti-DYKDDDDK Tag 자기 비드는 고품질 재조합 마우스 단일클론 항체와 공유 결합된 하이드록실 자기 비드를 기반으로 합니다. DYKDDDDK-태그 단백질의 높은 로딩(0.6 mg 단백질/mL 이상)과 높은 특이성을 가지고 있어 공동 면역침강 및 단백질 정제에 사용하는 것이 좋습니다.
특성
| 항체 동형 | 재조합 마우스 단일클론 항체 |
|---|---|
| 항체 정제 | Protein A 정제 |
| 응용 | 면역침강 및 단백질 정제 |
| 권장량 | IP: 200 μl 조단백질 용액에 20 μl 비드 |
| 결합 용량 | 자기 비드 1 ml당 최소 0.6 mg 단백질 용출 |
| 결합 특성 | Met-N-말단 DYKDDDDK Tag 융합 단백질: Met-DYKDDDDK Tag–단백질 N-말단 DYKDDDDK Tag 융합 단백질: DYKDDDDK Tag–단백질 C-말단 DYKDDDDK Tag 융합 단백질: 단백질-DYKDDDDK Tag |
보관 (수령일로부터)
2-8°C에서 2년 동안 보관하십시오.
프로토콜
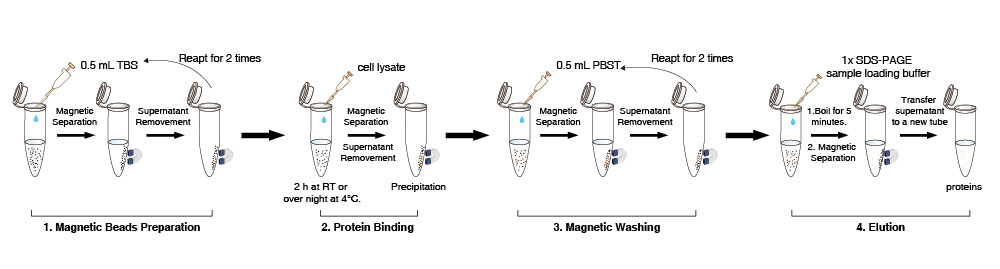
자기 비드 준비
1. 바이알에 있는 Anti-DYKDDDDK Tag 자기 비드를 현탁시킵니다 (10회 부드럽게 피펫팅하고, 볼텍싱하지 마십시오). 10 µL (필요에 따라 양을 조절할 수 있음)의 Anti-DYKDDDDK Tag 자기 비드 현탁액을 새 튜브로 옮깁니다.
2. 0.5 mL TBS 버퍼 (50 mM Tris HCl, 150 mM NaCl, pH 7.4)를 추가합니다. Anti-DYKDDDDK Tag 자기 비드를 5회 부드럽게 피펫팅합니다. 비드를 용액에서 분리하기 위해 1-2분 동안 (적절하게 5분까지 연장 가능) 튜브를 자석 위에 놓고 상층액을 제거합니다. 이 단계를 2회 반복합니다.
참고: 샘플이 배치 처리되는 경우 모든 자기 비드를 하나의 큰 튜브에 함께 준비한 다음 분할하십시오. 상층액을 제거할 때 너무 세게 흡입하면 일부 자기 비드가 손실될 수 있으므로 부드럽게 흡입하십시오.
단백질 결합
3. 세척된 자기 비드에 세포 용해물 500 µL를 추가합니다. 튜브를 실온에서 2시간 또는 4°C에서 밤새도록 부드럽게 회전시킵니다.
4. 비드를 용액에서 분리하기 위해 1-2분 동안 (적절하게 연장 가능) 튜브를 자석 위에 놓고, DYKDDDDK-태그 단백질 잔류 여부를 감지하기 위해 상층액을 새 튜브로 옮깁니다.
참고: 결합 과정에서 자기 비드가 가끔 뭉치더라도 결과에는 영향을 미치지 않습니다.
자기 세척
5. 튜브에 500 µL PBST를 추가합니다 (NaCl 136.89 mM; KCl 2.67 mM; Na2HPO4 8.1 mM; KH2PO4 1.76 mM; 0.5% Tween20), 부드럽게 피펫팅하여 자기 비드를 재현탁시킵니다. 그런 다음 튜브를 5분 동안 회전시킵니다. 튜브를 자석 위에 놓고 10초 동안 비드를 용액에서 분리하고 상층액을 제거합니다.
6. 5단계를 약 2회 반복합니다. 비특이적 불순물 단백질이 남아있는 경우, 세척 시간을 연장하거나, 세척 횟수를 늘리거나, 세척액 내 세제 함량을 적절히 늘리십시오.
용출 및 검출
하위 사용에 따라 다른 용출 방법을 선택하십시오. IP의 경우 7-8단계로 이동하십시오. 단백질 정제의 경우 저pH 용출을 위해 9-10단계로 이동하십시오.
변성 용출 (Anti-DYKDDDDK Tag 비드를 사용하는 IP 실험에 적합):
7. 표적 단백질의 직접 검출을 위해 위에서 언급된 침전물에 50 µL의 1×단백질 샘플 로딩 버퍼를 추가하고, 5분 동안 끓이고, 실온으로 식힌 다음 튜브를 자석 위에 놓고 비드를 용액에서 1-2분 동안 분리합니다 (적절하게 연장 가능).
8. SDS-PAGE로 상층액을 검출합니다.
경쟁적 폴리 DYKDDDDK Tag 폴리펩타이드 용출 (Anti-DYKDDDDK Tag 비드를 사용한 단백질 정제에 적합):
9. 6단계의 제품에 200 µg-1 mg/mL Poly DYKDDDDK Tag Peptide (B23111)가 포함된 TBS 버퍼를 추가하고, 쉐이커 (4°C)에서 2시간 동안 배양합니다. 일반적으로 Poly DYKDDDDK Tag Peptide의 부피는 젤의 5배입니다.
10. 위 단계의 제품을 자기 분리 장치에 놓고 자기 분리를 수행합니다. 표적 단백질을 포함하는 상층액을 새 EP 튜브로 옮깁니다. 자기 비드를 재사용해야 하는 경우, 0.1 M 글리신 HCl (pH 3.0)로 젤을 세척하고 재활용을 수행하십시오.
저pH 용출 (Anti-DYKDDDDK Tag 비드를 사용한 단백질 정제에 적합):
11. 6단계의 제품에 0.1 M 글리신 HCl (pH 3.0) 용출 버퍼를 추가하고, 쉐이커에서 5분 동안 배양합니다 (용출 시간은 20분 미만이어야 합니다). 일반적으로 용출 버퍼의 부피는 젤의 5배입니다.
12. 위 단계에서 얻은 제품을 5000 rpm에서 30초 동안 원심분리합니다. 그런 다음 용출 제품을 1 M Tris (pH 8.0)로 신속하게 옮겨 pH가 중성에 가까워질 때까지 중화시킵니다.
문제 해결
| 문제 | 가능한 원인 | 제안된 개선 사항 |
|---|---|---|
| 높은 배경 | 항체, 자기 비드 또는 EP 튜브에 단백질이 비특이적으로 결합 | 비특이적 결합 단백질을 제거하기 위해 용해물을 사전 정제합니다. 최종 세척을 위해 비드를 현탁시킨 후, 전체 샘플을 깨끗한 EP 튜브로 옮긴 다음 자기 분리를 수행합니다. |
| 세척 시간이 충분하지 않습니다. | 세척 횟수를 늘립니다. 세척 시간을 늘립니다. |
|
| 신호가 관찰되지 않습니다. | DYKDDDDK-태그 단백질이 샘플에서 발현되지 않습니다. | 관심 단백질에 DYKDDDDK Tag 서열이 포함되어 있는지 확인합니다. 신선한 용해물을 준비합니다. 적절한 프로테아제 억제제를 사용합니다. |
| 배양 시간이 부적절합니다. | 배양 시간을 늘립니다. | |
| 샘플에 방해 물질이 존재합니다. | 용해물에 고농도의 디티오트레이톨 (DTT), 2-메르캅토에탄올 또는 기타 환원제가 포함될 수 있습니다. 과도한 세제 농도는 항체-항원 상호작용을 방해할 수 있습니다. |
파일 다운로드
관련 기타 제품
기술 지원
다른 문의사항이 있으시면 메시지를 남겨주세요.
