연구용
Sulforhodamine B sodium salt Dyes 화학물질
제품 번호S5976
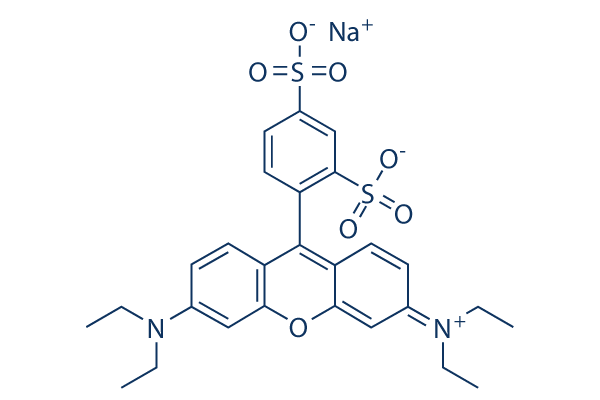
화학 구조
분자량: 580.65
품질 관리
화학 정보, 보관 및 안정성
| 분자량 | 580.65 | 화학식 | C27H29N2NaO7S2
|
보관 (수령일로부터) | 3 years -20°C powder |
|---|---|---|---|---|---|
| CAS 번호 | 3520-42-1 | -- | 원액 보관 |
|
|
| 동의어 | SRB, Acid Red 52, Kiton Red 620 | Smiles | [Na+].CCN(CC)C1=CC2=C(C=C1)C(=C3C=CC(C=C3O2)=[N+](CC)CC)C4=C(C=C(C=C4)[S]([O-])(=O)=O)[S]([O-])(=O)=O | ||
용해도
|
In vitro |
Water : 100 mg/mL
DMSO
: Insoluble
Ethanol : Insoluble |
몰농도 계산기
|
In vivo |
|||||
생체 내 제형 계산기 (투명한 용액)
1단계: 아래 정보 입력 (권장: 실험 중 손실을 고려하여 추가 동물 포함)
2단계: 생체 내 제형 입력 (이것은 계산기일 뿐 제형이 아닙니다. 용해도 섹션에 생체 내 제형이 없는 경우 먼저 당사에 문의하십시오.)
계산 결과:
작업 농도: mg/ml;
DMSO 원액 준비 방법: mg 약물 사전 용해 μL DMSO ( 원액 농도 mg/mL, 농도가 해당 약물 배치의 DMSO 용해도를 초과하는 경우 먼저 당사에 문의하십시오. )
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가μL PEG300, 혼합하고 투명하게 한 다음 추가μL Tween 80, 혼합하고 투명하게 한 다음 추가 μL ddH2O, 혼합하고 투명하게 합니다.
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가 μL 옥수수 기름, 혼합하고 투명하게 합니다.
참고: 1. 다음 용매를 추가하기 전에 액체가 투명한지 확인하십시오.
2. 용매를 순서대로 추가해야 합니다. 다음 용매를 추가하기 전에 이전 추가에서 얻은 용액이 투명한 용액인지 확인해야 합니다. 와동, 초음파 또는 뜨거운 물 중탕과 같은 물리적 방법을 사용하여 용해를 도울 수 있습니다.
작용 메커니즘
| 시험관 내(In vitro) |
세포 배양에서 Sulforhodamine B 비색 분석을 통한 세포 증식 분석 |
참조 |
|---|
임상시험 정보
(데이터 출처 https://clinicaltrials.gov, 업데이트 날짜 2024-05-22)
| NCT 번호 | 모집 | 조건 | 스폰서/협력자 | 시작일 | 단계 |
|---|---|---|---|---|---|
| NCT04862260 | Recruiting | Pancreatic Ductal Adenocarcinoma|Pancreatic Cancer|Pancreas Cancer|Metastatic Cancer |
CHU de Quebec-Universite Laval|Canadian Institutes of Health Research (CIHR)|Biovalorem |
October 4 2021 | Early Phase 1 |
| NCT03451513 | Completed | Eating Disorder|Body Image |
San Diego State University|National Institute on Minority Health and Health Disparities (NIMHD) |
January 24 2018 | Not Applicable |
