연구용
XL147 analogue PI3K 억제제
제품 번호S1118
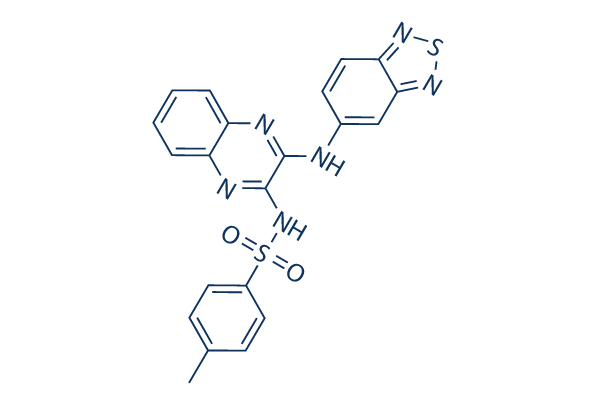
화학 구조
분자량: 448.52
품질 관리
화학 정보, 보관 및 안정성
| 분자량 | 448.52 | 화학식 | C21H16N6O2S2 |
보관 (수령일로부터) | |
|---|---|---|---|---|---|
| CAS 번호 | 956958-53-5 | SDF 다운로드 | 원액 보관 |
|
|
| 동의어 | SAR245408 | Smiles | CC1=CC=C(C=C1)S(=O)(=O)NC2=NC3=CC=CC=C3N=C2NC4=CC5=NSN=C5C=C4 | ||
용해도
|
In vitro |
DMSO
: 3 mg/mL
(6.68 mM)
Water : Insoluble Ethanol : Insoluble |
몰농도 계산기
|
In vivo |
|||||
생체 내 제형 계산기 (투명한 용액)
1단계: 아래 정보 입력 (권장: 실험 중 손실을 고려하여 추가 동물 포함)
2단계: 생체 내 제형 입력 (이것은 계산기일 뿐 제형이 아닙니다. 용해도 섹션에 생체 내 제형이 없는 경우 먼저 당사에 문의하십시오.)
계산 결과:
작업 농도: mg/ml;
DMSO 원액 준비 방법: mg 약물 사전 용해 μL DMSO ( 원액 농도 mg/mL, 농도가 해당 약물 배치의 DMSO 용해도를 초과하는 경우 먼저 당사에 문의하십시오. )
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가μL PEG300, 혼합하고 투명하게 한 다음 추가μL Tween 80, 혼합하고 투명하게 한 다음 추가 μL ddH2O, 혼합하고 투명하게 합니다.
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가 μL 옥수수 기름, 혼합하고 투명하게 합니다.
참고: 1. 다음 용매를 추가하기 전에 액체가 투명한지 확인하십시오.
2. 용매를 순서대로 추가해야 합니다. 다음 용매를 추가하기 전에 이전 추가에서 얻은 용액이 투명한 용액인지 확인해야 합니다. 와동, 초음파 또는 뜨거운 물 중탕과 같은 물리적 방법을 사용하여 용해를 도울 수 있습니다.
작용 메커니즘
| Targets/IC50/Ki |
PI3Kγ
(Cell-free assay) 23 nM
PI3Kδ
(Cell-free assay) 36 nM
PI3Kα
(Cell-free assay) 39 nM
PI3Kβ
(Cell-free assay) 383 nM
|
|---|---|
| 시험관 내(In vitro) |
XL147 analogue는 ATP 경쟁 방식으로 Class I PI3K 동형 효소를 억제합니다. HER2를 과발현하는 인간 유방암 세포주 패널에서 이 화합물로 처리하면 AKT 및 S6 인산화가 억제될 뿐만 아니라 HER3 및 기타 RTK의 발현 및 인산화를 유도합니다. HER2+ 세포에서 HER3의 인산화는 HER2 티로신 키나아제에 의해 유지되어 인산화된 AKT (pAKT)의 부분적인 회복을 유도하여 이 화학 물질의 항종양 작용을 제한합니다. 또한 HER3의 녹다운 또는 항HER2 제제인 트라스투주맙 또는 라파티닙으로 처리하면 HER2+ 유방암 세포가 시험관 내 및 생체 내에서 이 제제에 민감해집니다. 이 억제제로 처리하면 BT474, HCC1937 등 모든 테스트된 세포주의 단층 성장을 용량 의존적으로 억제합니다. 이 화합물의 주요 효과는 세포 증식 억제입니다. 20 μM 농도에서 세포 사멸을 유도합니다. 이 화학 물질로 처리하면 PI3K의 용량 의존적 억제가 발생합니다. 세포 증식 억제와 일치하게, 사이클린 D1 및 pRB의 감소와 CDK 억제제 p27KIPI 수준의 증가를 유도하지만 전체 또는 절단된 폴리(ADP-리보스) 폴리머라제(PARP) 수준에는 감지 가능한 변화가 없습니다. 이 제제로 처리하면 pAKTS473/T308 및 pS6S240/244의 용량 의존적 감소가 발생합니다. 놀랍게도, 또한 총 HER3 및/또는 pHER3Y1289 수준의 상향 조절을 유발합니다. HER2 과발현 세포에서 PI3K의 억제는 HER3를 포함한 여러 수용체 티로신 키나아제의 발현 및 인산화의 상향 조절이 뒤따릅니다. FoxO1 및 FoxO3a 전사 인자의 녹다운은 PI3K 억제 시 HER3, InsR, IGF1R 및 FGFR2 mRNA의 유도를 방지합니다. HER2+ 세포에서 siRNA로 HER3를 녹다운하거나 HER2 억제제인 트라스투주맙 또는 라파티닙과 병용 처리하면 XL147 유도 세포 사멸 및 pAKT 및 pS6 억제가 향상됩니다.
|
| 생체 내(In vivo) |
BT474 이종이식을 가진 무흉선 마우스는 XL147 analogue, 라파티닙, 트라스투주맙 또는 이 화합물과 각 HER2 길항제로 무작위로 처리됩니다. 각 단일 요법은 종양 성장을 유의하게 억제했으며, 트라스투주맙만이 8마리 중 1마리에서 완전한 종양 퇴행을 유도한 유일한 제제였습니다. 두 조합 모두 단독으로 투여된 해당 약물보다 우수했습니다. 특히, 트라스투주맙과 이 화학 물질의 조합은 라파티닙과 XL147의 조합이 아닌, 8마리 중 3마리에서 완전한 종양 반응을 유도했습니다. 어떤 치료군에서도 약물 관련 독성은 현저하게 나타나지 않았습니다. 이 화합물과 트라스투주맙의 조합은 다른 어떤 치료법보다 pHER3를 더 강력하게 예방했습니다. 치료군 간의 종양 성장 차이와 잘 일치하게, XL147과 라파티닙 또는 이 화학 물질과 트라스투주맙으로 처리된 종양에서 핵 pAKT는 단일 제제로 처리된 종양보다 낮았습니다. 세 가지 단일 약물 중 이 화합물은 핵 pAKT 수준을 통계적으로 억제하는 것으로 나타난 유일한 약물이었습니다. 세포질 pAKT 수준에는 감지할 만한 변화가 없었습니다. HER2 의존성 이종이식에서 HER2와 PI3K의 복합 억제는 PI3K/AKT 경로의 신호 전달 출력을 최대한 억제하는 데 필요합니다.
|
참조 |
|
임상시험 정보
(데이터 출처 https://clinicaltrials.gov, 업데이트 날짜 2024-05-22)
| NCT 번호 | 모집 | 조건 | 스폰서/협력자 | 시작일 | 단계 |
|---|---|---|---|---|---|
| NCT01943838 | Completed | Neoplasm Malignant |
Sanofi |
October 2013 | Phase 1 |
| NCT01436565 | Completed | Solid Tumor Cancers |
Sanofi|Merrimack Pharmaceuticals |
November 2011 | Phase 1 |
| NCT01392924 | Completed | Neoplasm Malignant |
Sanofi |
August 2011 | Phase 1 |
| NCT01357330 | Completed | Solid Tumors |
Sanofi |
May 2011 | Phase 1 |
| NCT01240460 | Completed | Glioblastoma|Astrocytoma Grade IV |
Sanofi |
January 2011 | Phase 1 |
