연구용
JNK-IN-8 JNK 억제제
제품 번호S4901
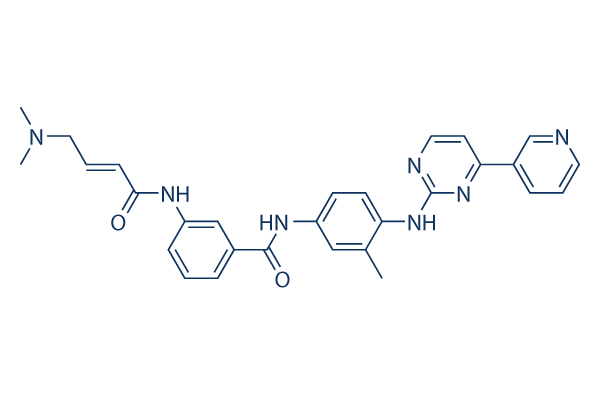
화학 구조
분자량: 507.59
품질 관리
세포 배양, 처리 및 작업 농도
| 세포주 | 분석 유형 | 농도 | 배양 시간 | 제형 | 활성 설명 | PMID |
|---|---|---|---|---|---|---|
| human HeLa cells | Function assay | 1 h | Inhibition of JNK3-mediated c-jun phosphorylation in human HeLa cells after 1 hr incubation, IC50=0.486 μM | 25415535 | ||
| human A375 cells | Function assay | 1 h | Inhibition of JNK3-mediated c-jun phosphorylation in human A375 cells after 1 hr incubation, IC50=0.338 μM | 25415535 | ||
| 클릭하여 더 많은 세포주 실험 데이터 보기 | ||||||
화학 정보, 보관 및 안정성
| 분자량 | 507.59 | 화학식 | C29H29N7O2 |
보관 (수령일로부터) | |
|---|---|---|---|---|---|
| CAS 번호 | 1410880-22-6 | SDF 다운로드 | 원액 보관 |
|
|
| 동의어 | JNK Inhibitor XVI | Smiles | CC1=C(C=CC(=C1)NC(=O)C2=CC(=CC=C2)NC(=O)C=CCN(C)C)NC3=NC=CC(=N3)C4=CN=CC=C4 | ||
용해도
|
In vitro |
DMSO
: 100 mg/mL
(197.0 mM)
Water : Insoluble Ethanol : Insoluble |
몰농도 계산기
|
In vivo |
|||||
생체 내 제형 계산기 (투명한 용액)
1단계: 아래 정보 입력 (권장: 실험 중 손실을 고려하여 추가 동물 포함)
2단계: 생체 내 제형 입력 (이것은 계산기일 뿐 제형이 아닙니다. 용해도 섹션에 생체 내 제형이 없는 경우 먼저 당사에 문의하십시오.)
계산 결과:
작업 농도: mg/ml;
DMSO 원액 준비 방법: mg 약물 사전 용해 μL DMSO ( 원액 농도 mg/mL, 농도가 해당 약물 배치의 DMSO 용해도를 초과하는 경우 먼저 당사에 문의하십시오. )
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가μL PEG300, 혼합하고 투명하게 한 다음 추가μL Tween 80, 혼합하고 투명하게 한 다음 추가 μL ddH2O, 혼합하고 투명하게 합니다.
생체 내 제형 준비 방법: 취하다 μL DMSO 원액, 다음 추가 μL 옥수수 기름, 혼합하고 투명하게 합니다.
참고: 1. 다음 용매를 추가하기 전에 액체가 투명한지 확인하십시오.
2. 용매를 순서대로 추가해야 합니다. 다음 용매를 추가하기 전에 이전 추가에서 얻은 용액이 투명한 용액인지 확인해야 합니다. 와동, 초음파 또는 뜨거운 물 중탕과 같은 물리적 방법을 사용하여 용해를 도울 수 있습니다.
작용 메커니즘
| 특징 |
JNK-IN-8 and JNK-IN-7 are structurally very similar, but whereas the former is a specific covalent inhibitor of JNKs.
|
|---|---|
| Targets/IC50/Ki |
JNK3
(A375 cells) 1 nM
JNK1
(A375 cells) 4.7 nM
JNK2
(A375 cells) 18.7 nM
Kit (V559D,T670I)
(A375 cells) 56 nM
Kit (V559D)
(A375 cells) 92 nM
|
| 시험관 내(In vitro) |
JNK-IN-8은 HeLa 및 A375 세포에서 c-Jun 인산화를 각각 486 nM 및 338 nM의 EC50으로 억제합니다. 이 화합물은 선택성에서 극적인 개선을 보였고 IRAK1, PIK3C3, PIP4K2C 및 PIP5K3에 대한 결합을 제거했습니다. JNK2 억제를 위해 Cys116이 필요합니다. 이 화학물질(10 mM)은 IL-1R 세포에서 IL-1β에 의해 자극된 c-Jun 인산화를 억제하며, 이는 JNK의 확립된 기질입니다. JNK 아이소폼에 공유 결합하여 JNK 아이소폼의 전기영동 이동성에서 약간의 지연을 일으켰습니다. KinomeScan 접근법을 사용하여 아크릴아마이드 키나아제 억제제 라이브러리의 구조를 기반으로 광범위한 키나아제 선택성 프로파일링을 통해 JNK 키나아제를 억제하는 것으로 발견되었습니다. 이 화합물은 1,4-디아닐린 및 1,3-아미노벤조산 서브구조의 독특한 입체화학을 가지고 있습니다. ATP 결합 부위의 가장자리에 위치한 Cys 154에 접근하기 위해 L자형 타입 I 결합 구조를 채택합니다. |
| 키나아제 분석 |
결합 동역학 분석
|
|
결합 동역학 분석 A375 세포는 지정된 시간 동안 1 μM JNK-IN-8로 전처리됩니다. 배지를 제거하고 PBS로 세 번 세척합니다. 1 mL의 용해 버퍼 (1% NP-40, 1% CHAPS, 25 mM Tris, 150 mM NaCl, 인산화효소 억제제 칵테일 및 단백질 분해효소 억제제 칵테일)로 세포 펠렛을 재현탁합니다. 4℃에서 30분 동안 상하로 회전시킵니다. 라이세이트는 Eppendorf에서 15분 동안 1.4×104 rpm으로 원심분리하여 정제합니다. 정제된 라이세이트는 10DG 컬럼을 사용하여 키나아제 버퍼 (0.1% NP-40, 20 mM HEPES, 150 mM NaCl, 인산화효소 억제제 칵테일, 단백질 분해효소 억제제 칵테일)로 겔 여과됩니다. 겔 여과된 라이세이트의 총 단백질 농도는 약 5–15 mg/ml이어야 합니다. 세포 라이세이트는 ActivX의 프로브로 5 μM에서 1시간 동안 표지됩니다. 샘플은 DTT로 환원되고, 시스테인은 요오드아세트아미드로 차단되며, 과량의 시약을 제거하고 버퍼를 교환하기 위해 겔 여과됩니다. 2배 결합 버퍼 (2% Triton-100, 1% NP-40, 2 mM EDTA, 2배 PBS) 1부피와 스트렙타비딘 비드 슬러리 50 μL를 추가하고, 2시간 동안 상하로 회전시킨 후 7,000 rpm으로 2분 동안 원심분리합니다. 1배 결합 버퍼로 세 번, PBS로 세 번 세척합니다. 비드에 30 μL의 1배 샘플 버퍼를 추가하고, 샘플을 95℃에서 10분 동안 가열합니다. 샘플을 110V에서 SDS-PAGE 겔에 로딩합니다. 전이 후, 막은 JNK 항체로 면역블롯됩니다.
|
|
| 생체 내(In vivo) |
JNK-IN-8은 JNK 활성화를 특이적으로 표적하는 강력한 JNK 억제제입니다. 항진균 활성을 가지고 있습니다. |
참조 |
|
적용 분야
| 방법 | 바이오마커 | 이미지 | PMID |
|---|---|---|---|
| Western blot | Notch1 / c-Myc / Cyclin D1 / p21 c-Jun / p-c-Jun / ATF2 / p-ATF2 / Elk-1 / pElk-1 |

|
27941886 |
| Growth inhibition assay | Cell viability |
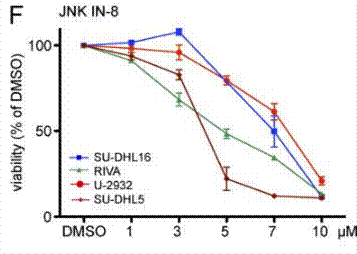
|
25847947 |
